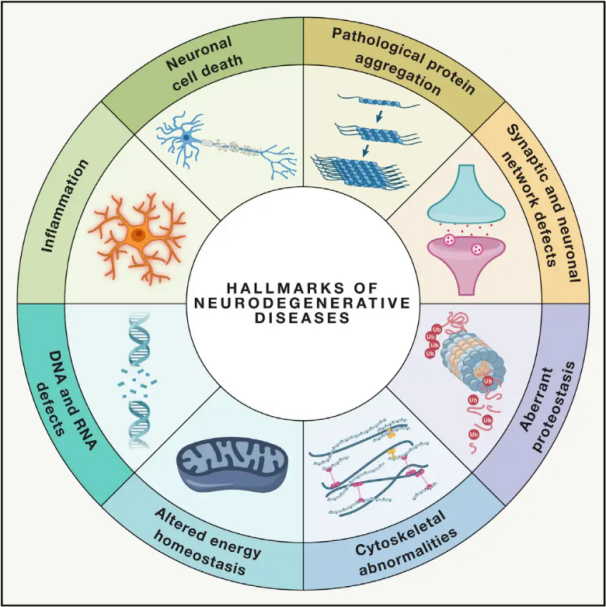
Neurodegenerativ Krankheeten(NDDs) si charakteriséiert duerch de progressive oder persistente Verloscht vu spezifesche vulnérabelen Neuronenpopulatiounen am Gehir oder Réckemuerch. D'Klassifikatioun vun NDDs kann op verschiddene Critèren baséieren, dorënner d'anatomesch Verdeelung vun der Neurodegeneratioun (wéi extrapyramidal Stéierungen, frontotemporal Degeneratioun oder spinocerebellar Ataxien), primär molekulare Anomalien (wéi Amyloid-β, Prionen, Tau oder α-Synuclein) oder wichteg klinesch Charakteristiken (wéi Parkinson-Krankheet, amyotrophesch Lateralsklerose an Demenz). Trotz dësen Ënnerscheeder an der Klassifikatioun a Symptompresentatioun deelen Stéierungen wéi Parkinson-Krankheet (PD), amyotrophesch Lateralsklerose (ALS) an Alzheimer-Krankheet (AD) gemeinsam zugronnleeënd Prozesser, déi zu neuronaler Dysfunktioun a schlussendlechem Zelltod féieren.
Well Millioune vu Leit weltwäit vun NDDs betraff sinn, schätzt d'Weltgesondheetsorganisatioun, datt dës Krankheeten bis 2040 déi zweethéchst Doudesursaach an den entwéckelte Länner wäerte sinn. Wärend et verschidde Behandlungen gëtt fir d'Symptomer ze linderen an ze behandelen, déi mat spezifesche Krankheeten verbonne sinn, bleiwen effektiv Methoden fir d'Progressioun vun dëse Konditiounen ze verlangsamen oder ze heelen, schwéier ze fannen. Rezent Studien weisen op eng Verännerung vun de Behandlungsparadigmen vun enger einfacher symptomatescher Behandlung hin zur Notzung vun Zellschutzmechanismen fir eng weider Verschlechterung ze verhënneren. Vill Beweiser suggeréieren, datt oxidativen Stress an Entzündung eng zentral Roll an der Neurodegeneratioun spillen, wat dës Mechanismen als kritesch Ziler fir de Zellschutz positionéiert. An de leschte Joren huet fundamental a klinesch Fuerschung de Potenzial vun der Hyperbaresch Sauerstofftherapie (HBOT) bei der Behandlung vun neurodegenerativen Krankheeten opgedeckt.
Hyperbaresch Sauerstofftherapie (HBOT) verstoen
HBOT besteet typescherweis doran, den Drock op iwwer 1 absolut Atmosphär (ATA) - den Drock um Mieresspigel - fir eng Dauer vun 90-120 Minutten ze erhéijen, wat dacks méi Sessiounen erfuerdert, ofhängeg vun der spezifescher Krankheet, déi behandelt gëtt. Den erhéichte Loftdrock verbessert d'Liwwerung vu Sauerstoff un d'Zellen, wat dann d'Stammzellproliferatioun stimuléiert an d'Heelungsprozesser, déi duerch bestëmmte Wuestumsfaktoren verursaacht ginn, verbessert.
Ursprénglech baséiert d'Uwendung vun HBOT op dem Boyle-Marriott-Gesetz, dat d'Drockofhängeg Reduktioun vu Gasblosen niewent de Virdeeler vun héije Sauerstoffniveauen an de Gewëss postuléiert. Et gëtt eng Rei vu Pathologien, déi bekanntlech vum hyperoxeschen Zoustand profitéieren, deen duerch HBOT verursaacht gëtt, dorënner nekrotesch Gewëss, Straleverletzungen, Traumata, Verbrennungen, Kompartimentsyndrom a Gasgangrän, ënner anerem opgezielt vun der Undersea and Hyperbaric Medical Society. Besonnesch ass et ze bemierken, datt HBOT och seng Effizienz als zousätzlech Behandlung bei verschiddene Modeller vun entzündlechen oder infektiöse Krankheeten, wéi Kolitis a Sepsis, bewisen huet. Wéinst senge entzündungshemmenden an oxidativen Mechanismen bitt HBOT e bedeitend Potenzial als therapeutesche Wee fir neurodegenerativ Krankheeten.
Präklinesch Studien iwwer hyperbar Sauerstofftherapie bei neurodegenerativen Krankheeten: Erkenntnesser aus dem 3×Tg Mausmodell
Eng vun de bemierkenswäerte Studienhuet sech op de 3×Tg Mausmodell vun der Alzheimer Krankheet (AD) konzentréiert, wat dat therapeutescht Potenzial vun HBOT fir d'Verbesserung vu kognitiven Defiziter gewisen huet. D'Fuerschung huet 17 Méint ale männleche 3×Tg Mais am Verglach mat 14 Méint ale männleche C57BL/6 Mais involvéiert, déi als Kontroll gedéngt hunn. D'Studie huet gewisen, datt HBOT net nëmmen d'kognitiv Funktioun verbessert huet, mä och d'Entzündung, d'Plaquebelaaschtung an d'Tau-Phosphoryléierung - e kritesche Prozess, deen mat der AD-Pathologie verbonnen ass - däitlech reduzéiert huet.
Déi schützend Effekter vun HBOT goufen op eng Ofsenkung vun der Neuroinflammatioun zréckgefouert. Dëst gouf duerch d'Reduktioun vun der Mikrogliaproliferatioun, der Astrogliose an der Sekretioun vu pro-inflammatoresche Zytokine bewisen. Dës Erkenntnisser ënnersträichen déi duebel Roll vun HBOT bei der Verbesserung vun der kognitiver Leeschtung a gläichzäiteger Reduktioun vun neuroinflammatoresche Prozesser, déi mat der Alzheimer Krankheet verbonne sinn.
En anert präklinescht Modell huet 1-Methyl-4-phenyl-1,2,3,6-tetrahydropyridin (MPTP) Mais benotzt fir d'Schutzmechanismen vun HBOT op neuronal Funktioun a motoresch Fäegkeeten ze evaluéieren. D'Resultater weisen datt HBOT zu enger verbesserter motorescher Aktivitéit a Grëffkraaft bei dëse Mais bäigedroen huet, wat mat enger Erhéijung vun der mitochondrialer Biogenesesignaliséierung korreléiert, speziell duerch d'Aktivéierung vu SIRT-1, PGC-1α an TFAM. Dëst ënnersträicht déi bedeitend Roll vun der mitochondrialer Funktioun an den neuroprotektiven Effekter vun HBOT.
D'Mechanismen vun HBOT bei neurodegenerativen Krankheeten
De Grondprinzip vun der Notzung vun HBOT fir NDDs läit an der Bezéiung tëscht reduzéierter Sauerstoffversuergung an der Ufällegkeet fir neurodegenerativ Verännerungen. Den Hypoxia-induzéierbare Faktor-1 (HIF-1) spillt eng zentral Roll als Transkriptiounsfaktor, deen d'zellulär Adaptatioun un eng niddreg Sauerstoffspannung erméiglecht, a gouf a verschiddenen NDDs, dorënner AD, PD, Huntington-Krankheet an ALS, implizéiert, wat en als e wichtegt Medikamentenziel markéiert.
Well den Alter e bedeitende Risikofaktor fir verschidde neurodegenerativ Stéierungen ass, ass et wichteg den Impakt vun HBOT op d'Neurobiologie vum Alterungsprozess z'ënnersichen. Studien hunn ugedeit, datt HBOT altersbedingt kognitiv Defiziter bei gesonde eelere Persoune verbessere kann.Zousätzlech hunn eeler Patienten mat bedeitende Gedächtnisstéierungen kognitiv Verbesserungen an e erhéichte zerebrale Blutfluss no der Belaaschtung mat HBOT gewisen.
1. Impakt vun HBOT op Entzündungen an oxidativen Stress
HBOT huet d'Fäegkeet bewisen, Neuroinflammatioun bei Patienten mat schwéierer Gehirdysfunktioun ze linderen. Et huet d'Fäegkeet, pro-inflammatoresch Zytokine (wéi IL-1β, IL-12, TNFα an IFNγ) erofzereguléieren, während et anti-inflammatoresch Zytokine (wéi IL-10) eropreguléiert. E puer Fuerscher proposéieren, datt reaktiv Sauerstoffspezies (ROS), déi duerch HBOT generéiert ginn, verschidde positiv Effekter vun der Therapie verursaachen. Dofir hänken, ofgesinn vun senger drockofhängeger Blasenreduktiounswierkung an der Erreeche vun enger héijer Sauerstoffsättigung am Gewëss, déi positiv Resultater, déi mat HBOT verbonne sinn, deelweis vun de physiologesche Rollen vun de produzéierte ROS of.
2. Auswierkunge vun HBOT op Apoptose an Neuroprotektioun
Fuerschung huet gewisen, datt HBOT d'Phosphoryléierung vun der p38 Mitogen-aktivéierter Proteinkinase (MAPK) am Hippocampus reduzéiere kann, wat duerno d'Kognitioun verbessert an de Schued am Hippocampus reduzéiert. Souwuel HBOT eleng wéi och a Kombinatioun mat Ginkgo biloba-Extrakt konnten d'Expressioun vu Bax an d'Aktivitéit vu Caspase-9/3 reduzéieren, wat zu enger reduzéierter Apoptosequote a Nagetiermodeller féiert, déi duerch aβ25-35 induzéiert goufen. Ausserdeem huet eng aner Studie gewisen, datt d'Konditionéierung vun HBOT eng Toleranz géint zerebral Ischämie induzéiert huet, mat Mechanismen, déi eng erhéicht SIRT1-Expressioun enthalen, zesumme mat erhéichte B-Zell-Lymphom 2 (Bcl-2)-Niveauen an enger reduzéierter aktivem Caspase-3, wat d'neuroprotektiv an anti-apoptotesch Eegeschafte vun HBOT ënnersträicht.
3. Afloss vun HBOT op d'Blutzirkulatioun anNeurogenese
D'Aussetzung vu Persounen un HBOT gouf mat verschiddenen Effekter um Schädelgefässsystem a Verbindung bruecht, dorënner d'Verbesserung vun der Blutt-Gehir-Barrière-Permeabilitéit, d'Fërderung vun der Angiogenese an d'Reduktioun vun Ödemer. Nieft der erhéichter Sauerstoffversuergung vun de Gewëss, huet HBOT ...fërdert d'vaskulär Bildungduerch d'Aktivéierung vu Transkriptiounsfaktoren wéi de vaskuläre endotheliale Wuesstumsfaktor an duerch d'Stimulatioun vun der Proliferatioun vun neuronalen Stammzellen.
4. Epigenetesch Effekter vun HBOT
Studien hunn opgedeckt, datt d'Beliichtung vu mënschleche mikrovaskuläre Endothelzellen (HMEC-1) mat hyperbarem Sauerstoff 8.101 Genen signifikant reguléiert, dorënner souwuel erop- wéi och erofreguléiert Genexpressiounen, wat eng Erhéijung vun der Genexpression ervirhieft, déi mat antioxidativen Äntwertweeër assoziéiert ass.
Conclusioun
D'Benotzung vun HBOT huet am Laf vun der Zäit bedeitend Fortschrëtter gemaach a seng Disponibilitéit, Zouverlässegkeet a Sécherheet an der klinescher Praxis bewisen. Wärend HBOT als off-label Behandlung fir NDDs exploréiert gouf a verschidde Fuerschunge gemaach goufen, bleift e dringende Besoin fir rigoréis Studien fir d'HBOT-Praktiken bei der Behandlung vun dëse Konditiounen ze standardiséieren. Weider Fuerschung ass essentiell fir optimal Behandlungsfrequenzen ze bestëmmen an den Ausmooss vun de beneficiellen Effekter fir Patienten ze bewäerten.
Zesummegefaasst weist d'Intersektioun vun hyperbarem Sauerstoff an neurodegenerativen Krankheeten eng villverspriechend Grenz vun therapeutesche Méiglechkeeten, déi weider Exploratioun a Validatioun am klineschen Ëmfeld rechtfäerdegt.
Zäitpunkt vun der Verëffentlechung: 16. Mee 2025

